Qué son los electrones de valencia y para qué sirven - ejemplos


Los átomos son unas diminutas partículas que forman toda la materia del universo y, cuando hablamos de ellos, estamos entrando en el mundo de la química. Dentro de cada átomo hay aún más partes pequeñas, como los protones, los neutrones y los electrones. Hoy vamos a centrarnos en una parte muy importante: los electrones de valencia.
En esta lección de unPROFESOR, vamos a explicarte detalladamente qué son los electrones de valencia y para qué sirven. Además, te podremos algunos ejemplos.
¿Qué son los electrones de valencia?
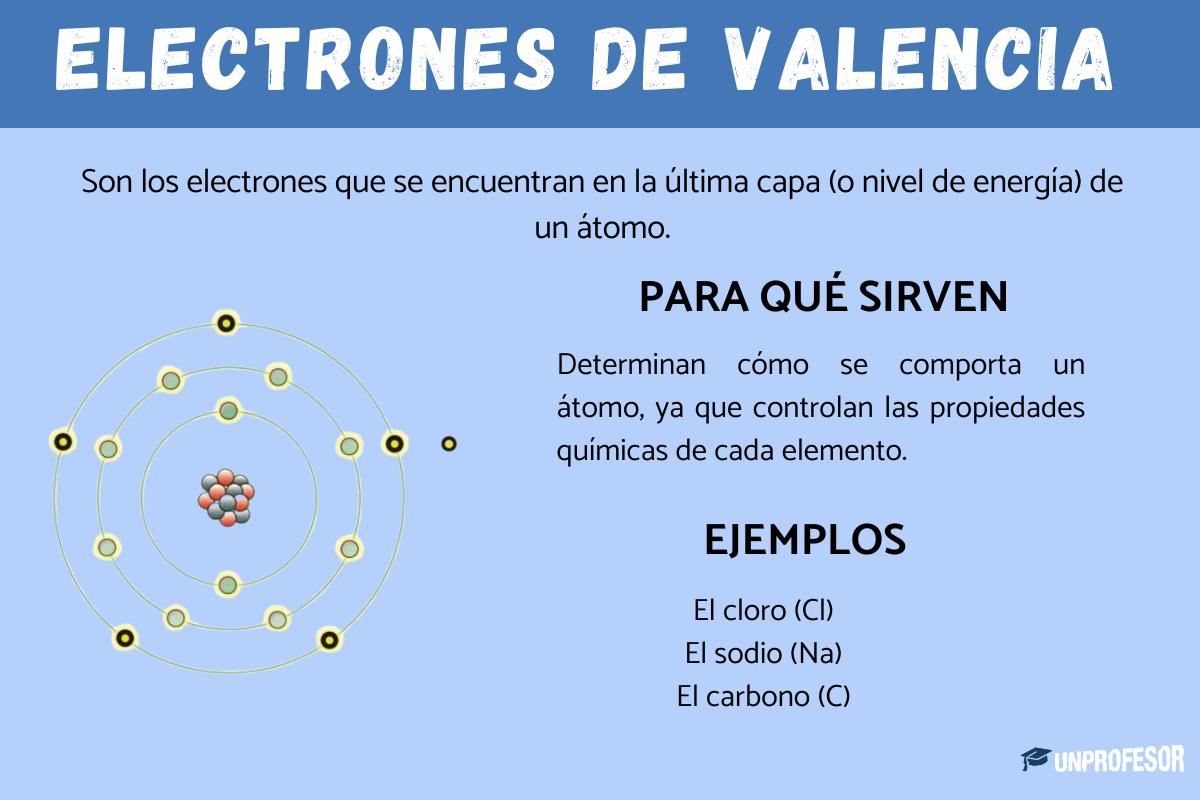
Los electrones de valencia son los electrones que se encuentran en la última capa (o nivel de energía) de un átomo. Imagina que el átomo es como una cebolla con varias capas. Los electrones viven en esas capas, girando alrededor del núcleo del átomo. Pues bien, los electrones de valencia son los que están más alejados del centro, en la capa externa.
Estos electrones son muy importantes porque son los que participan en las reacciones químicas y en la formación de enlaces con otros átomos. Es decir, los electrones de valencia permiten que los átomos se junten para formar moléculas, como el agua (H₂O), la sal (NaCl) o el dióxido de carbono (CO₂).
¿Cómo se representan los electrones de valencia?
La forma más reconocida de representar a los electrones de valencia es usando la estructura de Lewis. En esta representación, se dibuja el símbolo del elemento rodeado de puntitos, que representan los electrones de valencia. Por ejemplo:
- Cl: Cl∙∙∙∙∙∙∙ (7 puntitos alrededor)
- Na: Na∙ (1 puntito)
En esta otra lección te descubrimos las partes de un átomo y sus características.
Te dejamos el vídeo de nuestro profesor de química en el que te habla sobre la teoría de Lewis:

¿Para qué sirven los electrones de valencia?
Los electrones de valencia determinan cómo se comporta un átomo. Por ejemplo, si un átomo tiene muchos electrones de valencia, suele ser menos reactivo. Pero si tiene pocos, es más fácil que reaccione con otros átomos. Por eso, los electrones de valencia controlan las propiedades químicas de cada elemento.
También son los que permiten que los átomos cumplan la regla del octeto, que dice que los átomos tienden a tener 8 electrones en su capa externa para estar “felices” o estables, como los gases nobles (por ejemplo, el neón o el argón).
Los electrones de valencia tienen una función muy clara: formar enlaces entre átomos. Existen tres tipos principales de enlaces químicos que dependen directamente de cómo se comportan estos electrones.
Enlace iónico
Un enlace iónico ocurre cuando un átomo cede uno o más electrones y otro los recibe. Por ejemplo la sal de mesa (NaCl). El sodio cede su electrón de valencia al cloro, y así ambos quedan estables.
Enlace covalente
En este tipo de enlace, los átomos comparten electrones. Es el caso del agua (H₂O), donde el oxígeno comparte electrones con dos átomos de hidrógeno para formar una molécula.
Enlace metálico
Aquí, los electrones de valencia se mueven libremente entre los átomos de un metal. Esta “nube” de electrones libres permite la conductividad eléctrica, por eso los metales como el cobre y el aluminio conducen bien la electricidad.
¿Cómo saber cuántos electrones de valencia tiene un átomo?
Una forma sencilla de saber cuántos electrones de valencia tiene un elemento es mirando su posición en la tabla periódica:
- Los elementos del grupo 1 (como el hidrógeno o el sodio) tienen 1 electrón de valencia.
- Los del grupo 2 (como el magnesio o el calcio) tienen 2 electrones de valencia.
- Los del grupo 13 al 18, basta con restar 10 al número del grupo. Por ejemplo, el grupo 16 tiene 6 electrones de valencia (16 - 10 = 6).
Los elementos de transición (grupos del 3 al 12) son un poco más complicados, ya que su número de electrones de valencia puede variar. Pero para la mayoría de los elementos que usamos, este método es suficiente.
Ejemplos de electrones de valencia
A continuación, vamos a dejarte con algunos ejemplos de electrones de valencia para que entiendas mejor este concepto de la química.
Ejemplo 1: El cloro (Cl)
El cloro tiene el número atómico 17, lo que significa que tiene 17 electrones. Su configuración electrónica es 2, 8, 7, lo que quiere decir que tiene 7 electrones de valencia.
Como le falta solo un electrón para llegar a 8, es muy reactivo y siempre lucha por ganar un electrón formando compuestos como el cloruro de sodio (NaCl), que es la sal común.
Ejemplo 2: El sodio (Na)
El sodio tiene 11 electrones. Su distribución es 2, 8, 1. Solo tiene 1 electrón de valencia, y como está solito, lo cede fácilmente para quedar con una capa completa de 8 en el nivel anterior. Por eso es muy reactivo y forma fácilmente enlaces iónicos con elementos como el cloro.
Ejemplo 3: El carbono (C)
El carbono tiene 6 electrones: 2 en la primera capa y 4 en la segunda. Entonces, tiene 4 electrones de valencia. Esto le permite compartir esos 4 electrones con otros átomos y formar muchos tipos de moléculas, como el dióxido de carbono (CO₂), el metano (CH₄) y también los compuestos que forman nuestro cuerpo.
Ejemplo 4: El helio (He)
El helio es un gas noble y tiene solo 2 electrones, ambos en la primera y única capa. A pesar de no tener 8, su capa ya está completa, porque la primera capa solo necesita 2. Por eso, el helio es inactivo o inercia química, es decir, no reacciona fácilmente con nada.

¿Qué pasa si un átomo gana o pierde electrones de valencia?
Cuando un átomo pierde electrones de valencia, se convierte en un ion positivo (catión). Esto ocurre, por ejemplo, con los metales alcalinos (grupo 1).
Cuando un átomo gana electrones, se vuelve un ion negativo (anión). Esto lo vemos en los halógenos, como el cloro o el flúor.
Esta capacidad de ganar o perder electrones es lo que permite que se formen muchísimas sustancias diferentes.
Si deseas leer más artículos parecidos a Qué son los electrones de valencia y para qué sirven - ejemplos, te recomendamos que entres en nuestra categoría de El átomo.
- Chamizo, J. A., & Gutiérrez, M. Y. (2004). Conceptos fundamentales en química 1. Valencia. Educación Química, 15(4e), 359-365.
- Gutierrez, F. J. V. (1992). Analisis de series espectrales principal y subordinadas en sistemas con dos electrones de valencia (Doctoral dissertation, Universidad de Valladolid).